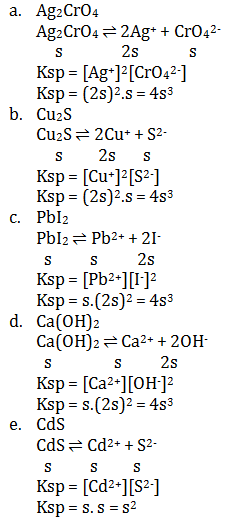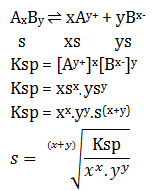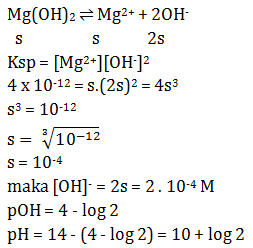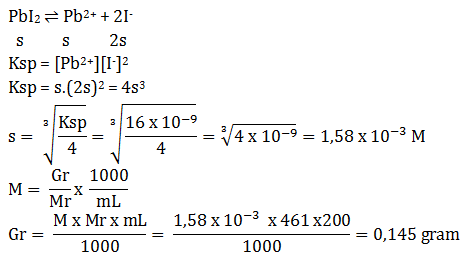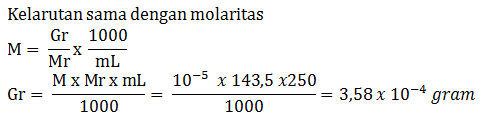Soal 1 Sebutkan pengertian asam basa menurut Arrhenius?Pembahasan :Asam = Spesi yang melapas H+ di dalam airBasa = Spesi yang melepas OH- dalam airContoh :
H2SO4(aq) → 2H+(aq) + SO42-(aq) → Karena mengion melepas H+ maka H2SO4 tergolong asam.
Ca(OH)2(aq) → Ca+2(aq) + 2OH-(aq) → Ca(OH)2 adalah basa karena melepaskan ion OH- dalam air.
Soal 2 Dari reaksi berikut :
Tentukanlah pasangan asam basa konjugasinnya dapat kita temui dalam konsep pengertian asam basa menurut Bronsted - Lowry?Pembahasan :Asam : donor H+Basa : Akseptor H+
Dari reaksi diatas dapa dilihat bahwa yang mendonorkan H+ nya adalah H2CO3 sehingga berubah menjadi HCO3-. Dalam hal ini H2CO3 bersifat asam sedangkan CN- yang menerima H+ sehingga berubah menjadi HCN adalah basanya.
Pasangan Asam Basa Konjugasi
H2CO3 : Asam dan HCO3- : Basa Konjugasi
CN- : Basa dan HCN : Asam Konjugasi
Soal 3 Apa yang dimaksud dengan indikator ?Pembahasan :Indikator adalah suatu asam lemah organik yang mempunyai warna berbeda pada rentang pH tertentu. Perumbahan warna dapat dijelaskan melalui reaksi berikut :
HIn ↔ H+ + In-
Warna 1 Warna 2
Prinsip Kerja indikatorIndikator akan membentuk suatu kesetimbangan seperti reaksi diatas. Jika dimasukkan ke dalam senyawa asam, maka artinya kita menambah konsentrasi ion H+ dalam reaksi kesetimbangan tersebt. Akibatnya kesetimbangan akan bergeser ke arah kiri sehinngga muncullah warna 1.
Jika kita masukkan ke dalam senyawa basa, maka H+ akan bereaksi dengan ion OH- dari basa sehingga jumlah H+ dalam reaksi kesetimbangan berkurang. Akibatnya kesetimbangan akan bergeser ke arah kanan dan muncullah warna 2.
Soal 4 Jelaskan perubahan warna lakmus merah dan biru jika dimasukan ke dalam larutan asam dan basa ?Pembahasan :Kertas Lakmus
Merah + asam =
MerahKertas Lakmus
Merah + basa =
BiruKertas Lakmus
Biru + asam =
MerahKertas Lakmus
Biru + basa =
Biru Soal 5 Apa yang dimaksud dengan titrasi asam basa ?Pembahasan :Titrasi asam basa adalah prosedur analisis kuantitatif dengan mengukur jumlah volume asam atau basa yang diperlukan untuk mentitrasi suatu asam atau basa lain yang belum diketahui konsentrasinya hingga mencapai titik ekivalen yaitu titik saat mol asam sama dengan mol basa.
Dalam titrasi berlaku :
n H+ = nOH-
Vasam x Masam x Valesni = Vbasa x Mbasa x Valensi
Soal 6 Apa yang dimaksud denga hidrolisis?Pembahasan :Hidrolisis adalah reaski suatu zat dengan air sehingga kesetimbangan air yang bersifat netral diganggu oleh zat ini (garam yang ada komponen asam atau basa lemahnya) sehingga pH air berubah.
Soal 7 Tentukan pH dari larutan NaOH 0,01 M?Pembahasan :NaOH = Basa Kuat
Valensi basa = 1
[OH-] = Mbasa x Valensi
= 0,01 x 1
= 0,01 M = 10-2 M
pOH = - log [OH-]
= - log 10-2
= 2
pH = 14 - 2 = 12
Soal 8 Tentukanlah volume larutan HCl 0,2 M yang diperlukan untuk mentitrasi 20 mL NaOH 0,1 M?Pembahasan:Dalam titrasi berlaku :
n H+ = nOH-
Vasam x Masam x Valesni = Vbasa x Mbasa x Valensi
Vasam x 0,2 M x 1 = 20 mL x 0,1 M x 1
V asam = 2/0,2 = 10 mL
Soal 9 Tentukanlah pH larutan (NH4)2SO4 0,9 M yang terhidrolisis sebagian dalam air (Kw = 10-14 dan Kb = 1,8 x 10-5)?Pembahasan :(NH4)2SO4 adalah garam yang berasal dari BL + AK sehingga yang mengalami hidrolisis adalah NH4+ nya
(NH4)2SO4 → 2NH4+ + SO42-
0,9 M 1,8 M 0,8 M
NH4+ yang terhidrolisis adalah = 1,8 M
Reaksi hidrolisisnya = NH4+ + H2O → NH4OH + H+
Larutan bersifat asam karena menghasilkan H+, sehinnga untuk mencai pH digunakan rumus :
pH = - log [H+]
= - log 10-4,5
= 4,5
Soal 10 Tuliskan reaksi hidrolisis garam berikut ini :A. Na3PO4B. K2CO3Pembahasan :a. Na3PO4 → 3Na+ + PO43-
yang mengalami hidrolisis adalah PO43-(Asam Lemah) (Hidrolisis sebagian / parsial)
Reaksi Hidrolisis :
PO43- + 3H2O → H3PO4 + 3OH-
b. K2CO3 → 2K+ + CO32-
yang mengalami hidrolisis adalah CO32-(Asam Lemah) (Hidrolisis Persial)
Reaksi hidrolisisnya :
CO32- + 2H2O → H2CO2 + 2OH-
Soal 11 Bersifat asam, basa atau netralkan larutan garam berikut:a. ZnSO4b. KCNPembahasan :a. ZnSO4 → Zn2+ + SO42-
Yang mengalami hidrolisi adalah Zn+2 karena berasal dari basa lemah Zn(OH)2
Reaksi Hidrolisis :
Zn+2 + 2H2O → Zn(OH)2 + H+
karena menghasilkan H+ berarti garam dalam larutannya bersifat asam
b. KCN → K+ + CN-
Yang mengalami hidrolisi adalah CN- yang berasal dari asam lemah(HCN)
Reaksi hidrolisisnya :
CN- + H2O → HCN + OH-
Karena menghasilkan OH- maka larutan garam ini bersifat basa
Soal 12 Di dalam 200 mL larutan terdapat 5,35 gram NH4Cl. jika Kb = 10-5 dan Ar N = 14, H= 1,Cl = 35,5; Hitunglah pH larutan tersebut?Pembahasan :n NH4Cl = gr/ Mr = 5,35/53,5 = 0,1 mol
M NH4Cl = n/V = 0,1 /0,2 = 0,5 M = 5 x 10-1
NH4Cl adalah garam AK + BL sehingga yang mengalami hidrolisis adalah NH4+ dari basa lemahnya.
Rx Hidrolisisnya :
NH4+ + H2O → NH4OH + H+
Karena menghasilkan ion H+ maka larutan bersifat asam, untuk mencari [H+} digunkan rumus :
pH = - log [H+]
= - log 2,23 x 10-5
= 5 - log 2,3
Soal 13 Larutan asam asetat 0,2 M sebanyak 25 mL (Ka = 10-5) dicampur dengan 25 mL larutan NaOH 0,2 M. Hitunglah pH campuran yang terjadi?Pembahasan :Campuran ini mungkin saja mebentuk larutan penyangga atau garam yang terhidrolisis. Untuk menentukanya maka perlu dlihat stoikiometri reaksinya terlebh dahulu.
n CH3COOH = M x V = 0,2 x 25 mL = 5 mmol
n NaOH = M x V = 25 mL x 0,2 = 5 mmol
Reaksi yang terjadi :
CH3COOH + NaOH → CH3COONa + H2O
mula 2 5 mmol 5 mmol - -
Reaksi 5 mmol 5 mmol 5 mmol 5 mmol
Sisa - - 5 mmol 5 mmol
Karena kedua pereaksi habis bereaksi maka yang tersisa dalam campuran adalah garamnya sehinnga garam ini akan terhidrolisis dan menentukan pH larutan.
M CH3COOH = 5/50 = 0,1 M = 10-1 M
CH3COONa mengalami hidrolisis parsial yaitu bagian CH3COO- nya
Reaksi hidrolisisnya :
CH3COO- + H2O → CH3COOH + OH-
Sifat larutan adalah basa, untuk menghitung [OH-] digunakan rumus :
gambar 5
pOH = -log [OH-]
= - log 10-5
= 5
pH = 14 - 5 = 9